磷酸盐ph计算公式 磷酸盐在ph多少下溶解
好久不见,今天给各位带来的是磷酸盐在ph多少下溶解,文章中也会对磷酸盐ph计算公式进行解释,如果能碰巧解决你现在面临的问题,别忘了关注本站,现在开始吧!
各种不同酸碱度浓度的磷酸缓冲液配制方法
1、磷酸盐缓冲液(pH0) 甲液:取磷酸16ml,加水至1000ml,摇匀。乙液:取磷酸氢二钠763g,加水使溶解成1000ml。取上述甲液75ml与乙液25ml混合,摇匀,即得。磷酸盐缓冲液(pH5) 取磷酸二氢钾100g,加水800ml,用盐酸调节pH至5,用水稀释至1000ml。
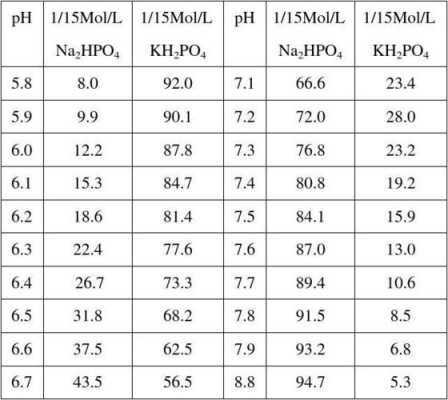
2、在配制PB缓冲液时,A液和B液按一定比例混合,例如A液X毫升加B液Y毫升等于0.2M的PB,再加水稀释至200毫升以得到0.1M的PB,具体的配比请参考下表:表1:PB缓冲液配比表 如果你需要不同浓度的PB,可以通过调整KH2PO4或NaH2PO4与Na2HPO4的毫升数,以及它们对应的pH值来进行定制。
3、通常可以使用以下配方: 9 mL 的磷酸二氢盐溶液 + 91 mL 的磷酸氢二钠溶液。当然,可以根据实际需要调整体积比例。将磷酸二氢盐溶液和磷酸氢二钠溶液分别取出所需体积,并倒入一个干净的容器中。
4、配制pH特定的缓冲液时,需根据缓冲液的配比计算所需的溶液体积。例如,配制pH 4的缓冲液,通常是将一定比例的磷酸二氢钠和磷酸氢二钠溶液混合。 将计算好的体积比例的磷酸二氢钠和磷酸氢二钠溶液倒入干净的容器中。
5、配制PBS缓冲液需要准确称取以下化学品:- 磷酸二氢钾 (KH2PO4):0.27克 - 磷酸氢二钠 (Na2HPO4·12H2O):42克 - 氯化钠 (NaCl):8克 - 氯化钾 (KCl):0.2克 首先,将这些化学品加入约800毫升去离子水中。 加入吐温-20,总量应控制在所需PBS缓冲液总体积的0.05%。
磷酸盐缓冲液的缓冲范围是多少啊?
1、磷酸缓冲液的缓冲pH值范围非常广泛,可配置各种pH值的酸性、碱性和中性缓冲液,配制酸性缓冲液可直接用NaH2PO4或KH2PO4,pH范围在1-5。碱性缓冲液可直接用Na2HPO4或K2HPO4,pH范围在9-12;中性缓冲液则用等浓度的NaH2PO4和Na2HPO4或者等浓度的KH2PO4和K2HPO4溶液混合,pH在5-5。
2、对于酸性缓冲溶液,其缓冲范围一般在pH 4-6之间。对于碱性缓冲溶液,其缓冲范围一般在pH 8-10之间。缓冲范围的确定与缓冲剂的选择密切相关。不同的缓冲剂有不同的缓冲范围。例如,乙酸/乙酸钠缓冲溶液的缓冲范围在pH 3-5之间,磷酸盐缓冲溶液的缓冲范围在pH 6-8之间。
3、pH缓冲范围:Tris-HCl的pH缓冲范围通常在pH8-8之间,这使得它在分子克隆和细胞培养等实验中非常有用。而PBS的pH值是固定的,为4,并且不会因为温度的变化而变化。这种稳定性使得PBS在某些对pH敏感的生物化学反应中非常有用。
4、首先,它们的成分不同。Tris缓冲液是由三羟甲基氨基甲烷(Tris)和盐酸配置而成的,而PBS缓冲液则是一种pH4的磷酸盐缓冲液。其次,它们的pH缓冲范围也不同。Tris-HCl的pH缓冲范围通常在pH8-8之间,而PBS的pH值是固定的,为4,并且不会因为温度的变化而变化。
5、标准缓冲溶液pH=00,碳酸钾,钾(蓝色,缓冲液pH00,Fisher Scientific FC Part Number: SB 115-500)或其等效物可以使用。碱性磷酸盐缓冲溶液(0.01M磷酸三钠,25℃时pH=172)—将42g无水磷酸氢钠(Na2HPO4)溶解在100ml 0.1M的不含碳酸盐的氢氧化钠溶液中,然后稀释到1L。
关于几种磷酸盐沉淀的溶度积及最佳控制PH的问题
投加NaOH调节pH值,控制混凝沉淀的最佳pH值为5~0,在此条件下,Zn2+与NaOH反应生成Zn(OH)2沉淀,而完全除去。石灰法化学沉淀除磷 投加石灰乳澄清液,调整pH值在10~11,废水中的绝大部分磷酸盐得以沉淀除去,石灰乳在除磷的同时还起到了中和作用。
又可在碱性溶液中溶解,因此,只在一定pH值范围才呈不溶性沉淀物,例如Zn(OH)2应控制pH值在9~10范围操作,当pH9,以Zn2+状态存在;pH5,以[Zn(OH)4]2-状态存在,pH值为9~10时,才以不溶性的Zn(OH)2沉淀存在,pH值不足或过高,均不能得到好的处理效果。
总酸度指磷酸盐、硝酸盐和酸的总和。总酸度一般以控制在规定范围 上限为好,有利于加速磷化反应,使膜层晶粒细,磷化过程中,总酸度不断下降,反映缓慢。总酸度过高,膜层变薄,可加水稀释。总酸度过低,膜层疏松粗糙。PH值锰系磷化液一般控制在2-3之间,当PH﹥3时,工件表面易生成粉末。当PH5时难以成膜。
磷酸盐缓冲液配制
磷酸盐缓冲液配制方法如下:称取8gNaCl、0.2gKCl、44gNa2HPO4和0.24gKH2PO4,溶于800ml蒸馏水中,用HCl调节溶液的pH值至4,zui后加蒸馏水定容至1L即可。在15lbf/in2(1034×105Pa)高压下蒸气灭菌(至少20分钟),保存存于室温或4℃冰箱中。
pbs缓冲液的配制是:含0.05%吐温-20的pH4的磷酸盐缓冲液(简称为PBS-T)配制方法为:称取磷酸二氢钾(KH2PO4)0.2g,磷酸氢二钠(Na2HPO4·12H2O)9g,氯化钠(NaCl)0g,氯化钾(KCl)0.2g,吐温-20 0.5mL,加水至1000mL。
磷酸盐缓冲液取磷酸二氢钠30g,与磷酸氢二钠04g,加水使成1000mL,即得。磷酸盐缓冲液(pH0)甲液:取磷酸16mL,加水至1000mL,摇匀。乙液:取磷酸氢二钠763g,加水使溶解成1000mL,取上述甲液75mL与乙液25mL混合,摇匀,即得。
磷酸盐在水中的溶解度受哪些因素的影响?
1、磷酸盐在水中的溶解度主要受到温度、pH值以及同离子效应等因素的影响。温度:磷酸盐的溶解度通常会随着温度的升高而增大。这是因为加热可以增加分子的运动速度,使得分子间的相互作用减弱,从而使得物质更容易溶解。pH值:磷酸盐在酸性溶液中的溶解度通常比在碱性溶液中的溶解度要高。
2、一般来说,磷酸盐的溶解度随着pH值的升高而降低。在中性或弱碱性条件下,磷酸盐通常易于溶解。然而,在酸性条件下,磷酸盐的溶解度可能会降低。此外,温度的变化也会影响磷酸盐的溶解度,一般来说,温度越高,溶解度越高。另外,当溶液中存在其他离子时,也会影响磷酸盐的溶解度。
3、底质中磷酸盐溶出速率的影响因素有:底质pH值:底质的pH值对磷酸盐的溶解和吸附有很大影响。在碱性环境下,磷酸盐溶解度较低,容易被底质吸附。而在酸性环境下,磷酸盐溶解度较高,容易被底质释放。底质的矿物质组成:矿物质的类型和含量会影响磷酸盐的吸附和溶解。
4、加入盐酸:CaHPO+2HCl=CaCl+HPO(沉淀溶解)【如果盐酸不足量,也会产生磷酸二氢钙和氯化钙部分溶解。2CaHPO+2HCl=CaCl+Ca(HPO)】。
PH=7.8的磷酸缓冲液的配置
1、准备磷酸盐缓冲液(pH8)甲液:取39克磷酸氢二钠,加入适量水中并溶解,稀释至500毫升。准备磷酸盐缓冲液(pH8)乙液:取76克磷酸二氢钠,加入适量水中并溶解,稀释至100毫升。将95毫升甲液和5毫升乙液混合,在混合过程中充分摇匀可得到pH8的磷酸缓冲液。
2、我没有计算,要是对缓冲溶液pH准确度要求不高的话,配些磷酸二氢钠和磷酸氢二钠标准溶液,往二氢钠溶液里面滴加氢二钠溶液,pH计即时测定,滴加的时候小心一点很容易配到你要的pH,缓冲体系本身具有一定的缓冲容量,加入PVP以及稀释到你要的浓度pH变化应该不大的。
3、详见药典2005版附录158页 甲液:取Na2HPO4 39g,加水溶解,并稀释至500mL 乙液:取NaH2PO4 76g,加水溶解,并稀释至100mL 取上述甲液95mL和乙液5mL,混合摇匀即得。
4、查出磷酸的第二电离常数,根据方程pH=PKa+lg([(HPO4)2-]/[(H2PO4)-]),把Ka第二电离常数代入,求得[(HPO4)2-]/[(H2PO4)-],这样得到了用Na2HPO4和NaH2PO4的配比,根据你称得它们的物质的量,再用容量瓶配制就得到你的目标溶液了。
到此,以上就是小编对于磷酸盐ph计算公式的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。